氮化锂






保持贮藏器密封、储存在阴凉、干燥的地方,确保工作间有良好的通风或排气装置。

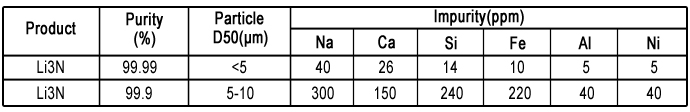
分子式:Li3N CAS:26134-62-3 密度:1.270g/cm3 外观:红色或紫色的固体 摩尔质量:34.83g·mol-1 熔点:813℃(1086K) log P :3.24 溶水性:会和水反应 | 氮化锂是碱金属氮化物中热稳定性最高的化合物,也是当中唯一一个可以在室温下制备的化合物。氮化锂熔点很高,常温下为紫色或红色的晶状固体。 氮化锂会和水剧烈反应,并产生氨。 Li3N (s) + 3H2O (l) → 3LiOH (aq) + NH3 (g) 细粉状的氮化锂可在空气中起火燃烧,因此氮化锂必须在惰性气体中储存和处理。氮化锂是超强碱,其碱性比负氢离子还要强,因此可以将氢去质子化: Li3N (s) + 2H2 (g) → LiNH2 (s) + 2LiH (s) 氮化锂在氢气中加热时可相继得到氨基锂(LiNH2)、亚氨基锂(Li2NH),最终转化为氢化锂,并放出氨。 由于上述的反应在摄氏270度时可逆,氮化锂可作为氢气储存的媒介,最多可吸收其重量11.5%的氢气。 |
氮化锂基本性质:
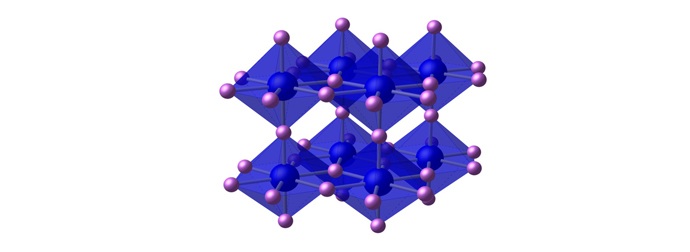
氮化锂的晶体构造相当特殊,可分为二层:其中一层为 Li2N-,其中的锂原子为六配位;而另一层只有锂离子。氮化锂是一种快离子导体(fast ion conductor)且其电导率比其他无机的锂盐都高。

一:氮化锂的制备可直接将元素氮和锂直接反应而成,通常是将锂在纯氮气中燃烧而制得,制得的产品纯度可达95%-99%。无论是在实验室还是在工业上,这种方法都是制备氮化锂最常用的方法。
二:将氮气通入溶解有金属锂的液态钠中,制备出的氮化锂纯度较高。
![]()
氮化锂可以作为有机合成中的催化剂或反应原料:
1.氮化锂(Li3N)是高温高压下合成(氮化硼)cBN的催化剂。氮化锂对高温高压下hBN向cBN的转变,常压高温下B4c与NH4a的反应有催化作用;还可以在溶剂热方法中作为与BBr3反应生成hBN和cBN的氮源。
2.制备双氟磺酰亚胺锂盐。双氟磺酰亚胺锂(LiN(SO2F)2以下简称LiFSI)是一个具有广泛应用前景的电解液物质。LiFSI的导电率适宜,且热稳定性、电化学稳定性高;发生副反应概率小,不会产生HF 等腐蚀性气体,是当今锂离子二次电池电解液中不可缺少的高新技术类产品。随着锂电行业不断发展,其市场需求必将越来越大,有可能成长为辅盐类锂盐化合物中的明星产品。
3.制备硼氮化锂(Li3BN2)。以碳化硼和氮化锂为原料合成Li3BN2,Li3BN2是合成超硬材料立方氮化硼的重要催化剂,已在合成立方氮化硼的工业生产中得到应用。
4.作为固体电解质。氮化锂是一种快离子导体且其电导率比其他无机的锂盐都高可作为电池固体电极及阴极材枓。
5.作为有机发光器件电子注入层,应用于OLED中可以有效的高OLED的效率,并且能降低器件的工作电压。






